摘要
- 網絡流傳一段影片宣稱預防COVID-19的mRNA疫苗危險,影片中有人宣稱接種後疫苗會進入全身各部位,更宣稱疫苗最集中在卵巢。
- 影片所引用的證據來自日本的疫苗審核報告,同樣資料可見於英國及歐盟的審核報告。
- 該項數據來自一個動物實驗,向大鼠注射疫苗使用的注射脂質納米粒(LNP),再觀察注射後LNP於身體各部位的分佈。
- 結果顯示,多個部位在注射後各個時段所檢測到的LNP份量只佔注射劑量不足1%甚至0.1%,最集中的部位為注射位置,其次為肝臟,而卵巢的數字僅為千分之一以下。
- 影片中宣稱疫苗注射後不停留在「它應在的地方」,但未有提及所引用數據顯示分佈比例懸殊,屬誤導內容。至於宣稱卵巢為疫苗最集中累積之處,屬錯誤內容。
- 關於影片其他就疫苗安全的宣稱,可參考︰mRNA疫苗「發明者」質疑疫苗有害?
背景
現時用作預防2019冠狀病毒病(COVID-19)的疫苗當中,有部分為採用新技術的「信使核糖核酸(messenger ribonucleic acid, mRNA)疫苗」,透過注射經修改的mRNA,讓接種者體內部分細胞製造SARS-CoV-2(引起COVID-19的病毒)表面的「刺突蛋白」(spike protein),從而讓免疫系統辨認及製造抗體。疫苗中的mRNA在身體製造刺突蛋白後便會分解,並無遺傳物質,不會如病毒般自我複製。[1]
Facebook專頁「雪行者」及「敗傲籮即高 嘥仁時 (Bio Sciences)」的帖文均引用一段YouTube影片指mRNA疫苗危險。截至8月3日,兩則帖文的分享次數合共有757次。[2,3]
兩則帖文均引用一段標題為〈刺突蛋白非常危險,具細胞毒性〉(Spike protein is very dangerous, it's cytotoxic)的網台節目影片,影片中有三人發言,包括馬龍(Robert Malone)、韋斯坦(Bret Weinstein)及卻茨(Steve Kirsch)。[4]

韋斯坦在影片中整理另外兩人意見,指mRNA疫苗有兩個問題︰[5]
- mRNA疫苗注射後不停留在「它應在的地方」,會散佈全身;
- mRNA疫苗令身體產生的刺突蛋白「非常危險」、具細胞毒性。
本文查核來自卻茨的第一個論點,關於第二點讀者可查看另一篇事實查核報告。
卻茨在影片中表示,必度(Byram Bridle)向日本政府取得疫苗的生物分佈數據,發現疫苗在接種後不只留在肩膀(注射位置),而是會散佈全身,甚至最集中在卵巢。[6]
查證
根據貴湖大學(University of Guelph)安大略獸醫學院(Ontario Veterinary College)網站的資料,必度為該校副教授。[7]
馬龍等人的YouTube影片簡介附上卻茨關於COVID-19疫苗的文章連結[8],但該篇文章須付費才可讀到。[9]卻茨的個人網站上有一篇題為〈疫苗資源〉(Vaccine resources)的文章,文中有其他反對疫苗的文章連結[10],當中連結了一份題為〈疫苗安全證據〉(Vaccine safety evidence)的PDF文件。[11]
〈疫苗安全證據〉第25頁提及必度的文章,宣稱必度向日本政府要求公開輝瑞藥廠(Pfizer)申請緊急授權使用疫苗的文件,從而發現輝瑞數據顯示疫苗並不停留在注射的三角肌上,而是到所有器官。[12]此說法跟卻茨影片說法相同。[13]不過,必度在其文章並無提及他向日本政府索取文件,反而明確指出資料來源為《英國醫學期刊 》(The BMJ)一篇文章的參考資料。[14]
這些資料與脂質納米粒(Lipid Nanoparticles, LNP)有關。如果直接注射mRNA到身體內,mRNA未進入目標細胞之前已會被分解,因此科學家會使用注射LNP把mRNA送進細胞內。[15]BioNTech及輝瑞的復必泰疫苗(Comirnaty,代號為BNT162b2)中含有4種LNP,其中兩種在自然界出現,會於身體內代謝及排出,另外兩種LNP——ALC-0315及ALC-0159——則需要進一步審核,以確保安全。[16]
必度(以及卻茨引述)所使用的資料,為日本負責審核疫苗[17]的醫藥品醫療機器綜合機構(PMDA)文件的表2.6.5.5B,圖表顯示在大鼠身上注射LNP後各個部位的含量。以下為文件相關頁面︰[18]
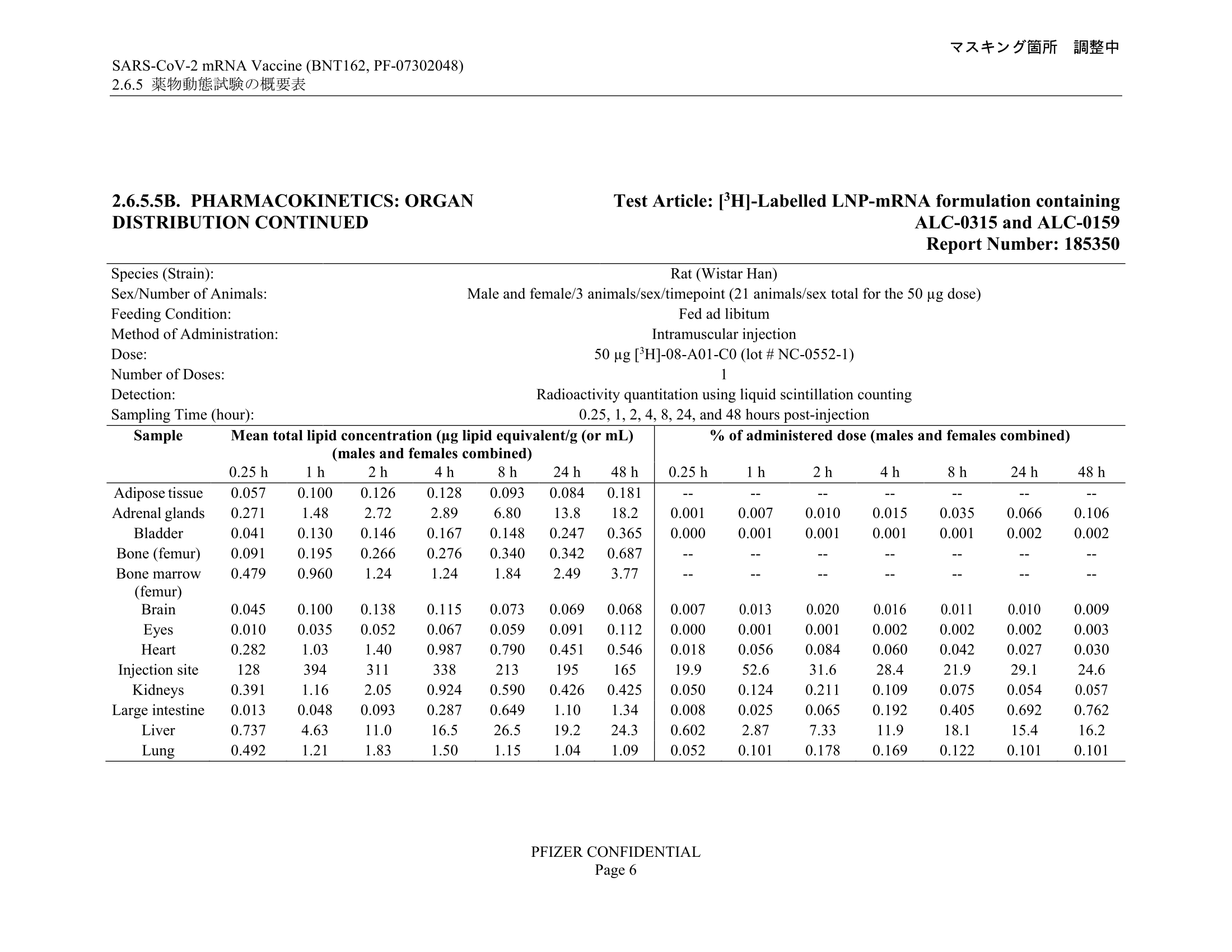
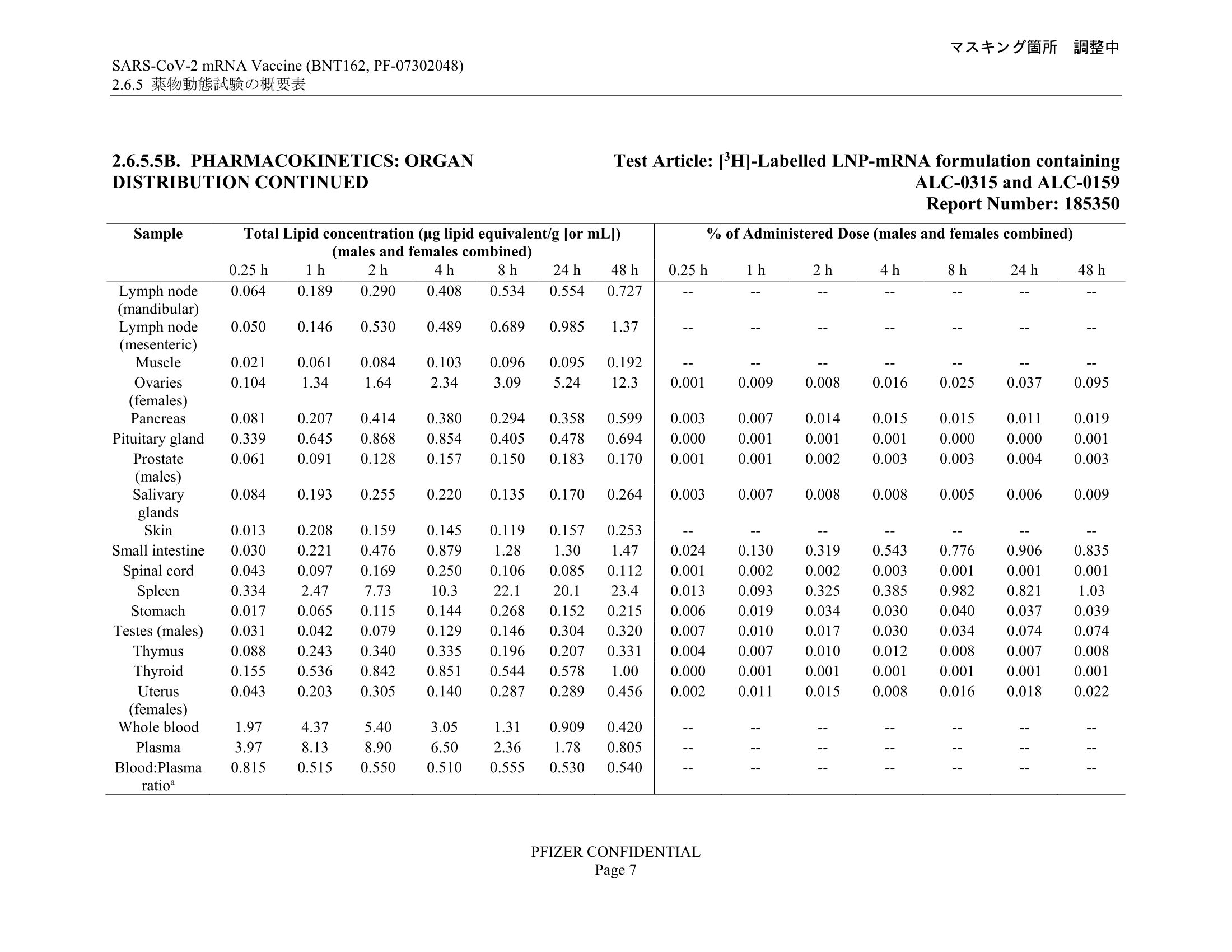

圖表描述的研究測試注射兩款需要進一步審核的LNP(ALC-0315及ALC-0159)至大鼠身上,注射方法為肌肉注射(intramuscular injection),劑量則為50微克(μg),並列出大鼠身體各部位在注射後0.25小時至48小時所檢測到的LNP濃度。
參考圖表右方的注射劑量比例(% of administered dose),列出的大多數部位在注射後各個時段所檢測到的LNP份量只佔注射劑量不足1%甚至0.1%,而主要檢測到LNP的部位為注射位置(injection site)以及肝臟(liver),在注射後48小時分別檢測到注射劑量的24.6%及16.2%。除這兩部位外,唯一檢測超過注射劑量1%的部位為脾(spleen),在注射後48小時檢測到注射劑量的1.03%(較早時段則在0.013%至0.982%之間)。
而且參考以上圖表就可發現,卻茨稱疫苗聚集最多在卵巢的說法亦錯誤,他引用的資料來源為必度的文章,卵巢的LNP濃度數字遠非首位,而且僅佔接種劑量的0.095%,即千分之一以下。
另外值得注意的是,必度的文章僅加入圖表左方,即只有濃度數字,然而未有提及實驗中大鼠接種的劑量為50微克,而保守估計人類體重為該品系(Wistar Han)的大鼠100倍以上[19],人類接種劑量所含的相關LNP則為每次480微克[20],換言之以每公斤劑量計算,實驗所注射的LNP比實際接種疫苗時高出超過10倍。
在歐洲藥品管理局(European Medicines Agency, EMA)就復必泰疫苗的審核報告中,亦提及數據顯示在大鼠實驗中,上述兩款LNP分別需要約6星期及2星期自肝臟排除。報告指申請者認為基於使用遠高於在人體接種劑量的重複劑量毒性試驗(repeat dose toxicity studies),兩款LNP並無任何非臨床的安全問題,而負責審核的人類用醫藥品委員會(Committee for Medicinal Products for Human Use, CHMP)同意此說法。[21]
EMA的審核報告也描述了上PMDA文件圖表2.6.5.5A及2.6.5.5B的相關研究。
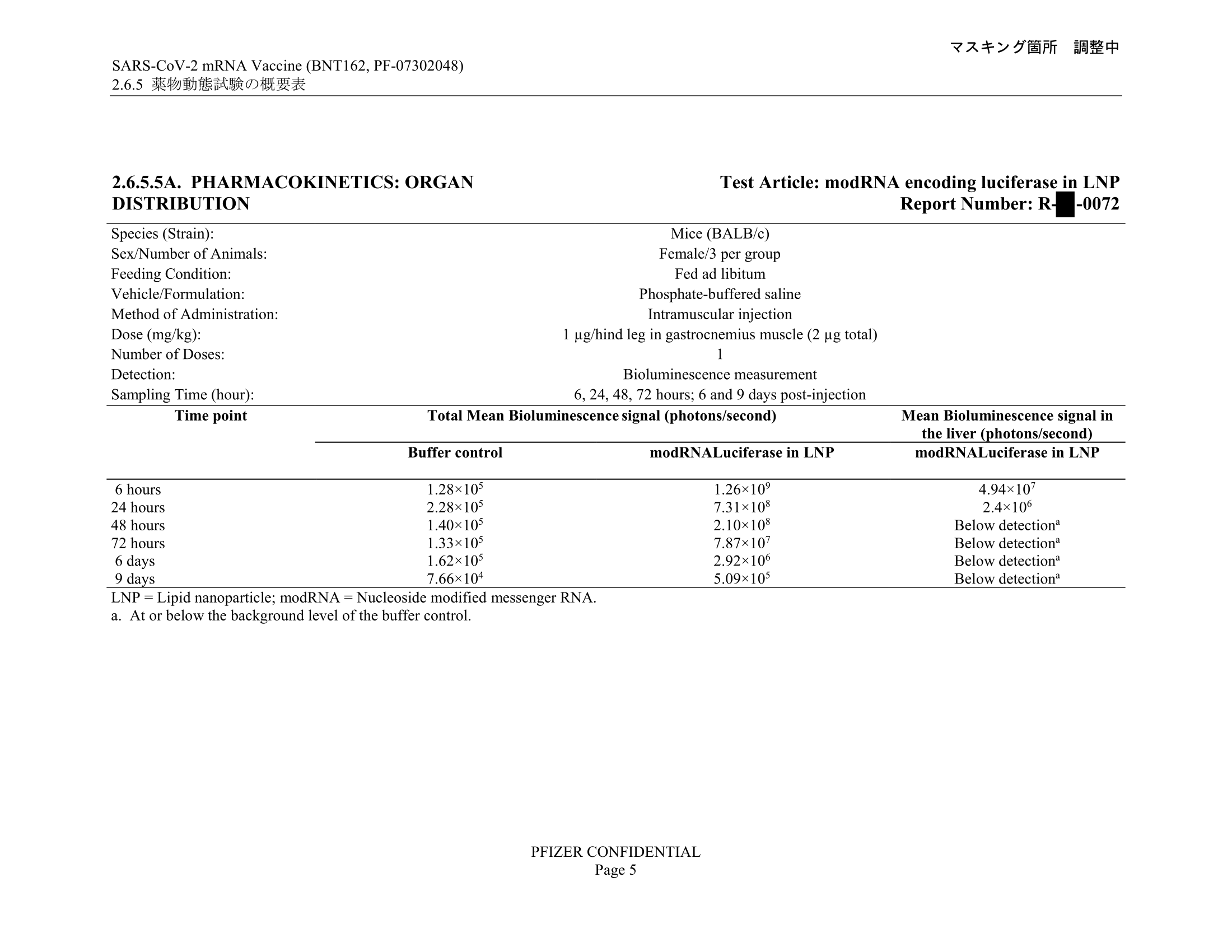
對比EMA審核報告的描述,圖7來自一項使用小鼠的研究(使用品BALB/c),該實驗肌肉注射2微克內含編碼螢光素酶(luciferase)的modRNA(經修改的mRNA)的LNP,6小時後注射位置的螢光素酶訊號達至頂峰,為對照組的10,000倍,其後不斷下降,9日後為對照組約7倍。而來自肝臟的訊號同樣於注射後6小時達至頂峰,並於注射後48小時下降至跟背景水平相約,圖7顯示在注射後72小時、6日及9日後同樣低於可偵測水平。[22]考慮到該種小鼠的體重在25克以下(實驗用雌性小鼠),實驗所注射的每公斤劑量為接種疫苗時的6倍以上。[23]
該報告另外引述三個向大鼠注射高劑量的BNT162b2的實驗,在兩個重複劑量毒性試驗中卵巢無任何與疫苗相關的發現,而發育與生殖毒性試驗(DART study)顯示對生育能力並無影響。[24,25]
對上述研究的分析,亦可參考英國衛生及社會關懷部(Department of Health and Social Care)對復必泰疫苗(BNT162b2)的審核報告[26]以及PMDA的英文版審核報告。[27]
結論
卻茨指疫苗接種後會走進全身,根據有關使用大鼠的研究數據,在注射後LNP主要聚集在注射位置,同時有部分會流到身體其他部分。但卻茨未有提及比例懸殊,屬誤導內容,並錯誤宣稱注射後卵巢的LNP濃度最高。
此外,卻茨宣稱必度向日本政府要求公開數據才發現有關資料,必度文章並無提及此事。而且有關研究結果出自公開的審核報告,同樣可見於英國、歐盟等的疫苗審核報告,卻茨的說法錯誤。
關於刺突蛋白的查證,請參考另一篇事實查核報告。
資料來源
- Different types of COVID-19 vaccines: How they work (Mayo Clinic)
- Facebook專頁「雪行者」2021年6月19日帖文(該專頁已被刪除)
- Facebook專頁「敗傲籮即高 嘥仁時 (Bio Sciences)」6月29日帖文
- Spike protein is very dangerous, it's cytotoxic (Robert Malone, Steve Kirsch, Bret Weinstein)(DarkHorse Podcast Clips YouTube頻道影片)
- 同[4],見影片5分15秒至5分55秒。
- 同[4],見影片4分31秒至5分27秒及6分06秒至6分15秒。卻茨於6分10秒說”And one of the scariest thing is that the biodistribution, like, peaks in your ovaries"。
- Byram W. Bridle(Ontario Veterinary College)
- 同[4],見簡介”Steve's paper on COVID vaccine reactions"後的連結。
- Should you get vaccinated? (TrialSiteNews)
- Vaccine resources (Skirsch.io)
- Vaccine safety evidence (Skirsch.io)
- 同[11],見第25頁,原句為”This is the paper that started it all. Dr. Bridle did a FOIA request to the Japanese government to get documents that Pfizer filed for their EUA in Japan. To his surprise, the Pfizer data he got back (labelled COMPANY CONFIDENTIAL) showed that the vaccine does not remain in the deltoid muscle (like vaccines are SUPPOSED to do) but goes into every organ.”,當中的"FOIA"原意為美國的《資訊自由法》(Freedom of Information Act),在美國此法常被引用作索取公開資料,此處用法引申為向日本政府要求公開資料。
- 同[4],卻茨於影片4分58秒開始提到“What Byram Bridle did, is he did a FOIA request to the Japanese government, to look at the biodistribution data.”。
- 必度的文章見COVID-19 Vaccines and Children: A Scientist’s Guide for Parents,搜尋”Japan”一詞可發現並無必度並無提到索取資料。提及資料來源的段落在PDF文件第22頁,原文為"A report that Pfizer provided to the Japanese government (see Appendix 2) was published as reference #25 in an article published in BMJ that can be found at this link."。
- May, M. After COVID-19 successes, researchers push to develop mRNA vaccines for other diseases. Nat Med 27, 930–932 (2021).
- Summary of the Public Assessment Report for COVID-19 Vaccine Pfizer/BioNTech (UK Department of Health and Social Care),見3.3 Pharmacokinetics。
- How domestic clinical trials slow Japan's vaccine approval process (The Japan Times)
- https://www.pmda.go.jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_1.pdf,見文件第16至18頁。
- 參考Charles River Lab及Envigo兩家發售Wister Han大鼠作實驗用途的公司提供的數字,14至15周的雄鼠平均重量在400克以下,即使人類體重以40公斤計算,兩者已相差100倍。美國疾病控制與預防中心(CDC)數字顯示美國20歲以上女性平均體重為170.8磅,即約77.5公斤以上;香港衞生署《二零一四至二零一五年度人口健康調查報告書》數據顯示受訪的香港15至84歲女性平均體重為56.5公斤(見第253頁),因此100倍屬保守估計。
- 參考《USA Today》引用輝瑞的數據,ALC-0315及ALC-0159分別為「(4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate)」及「2[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide」,接種劑量分別為0.43毫克(mg)及0.05毫克,合共0.48毫克,即480微克。注意Moderna疫苗並無這兩款LNP。
- Comirnaty : EPAR - Public assessment report (European Medicine Agency),見文件第46頁,相關段落為”For ALC-0315 (aminolipid), the maximum detected concentration in the liver (294 μg/g liver) was reached 3 hours after IV injection. ALC-0315 was eliminated slowly from the liver and after 2-weeks the concentration of ALC-0315 was still ~25% of the maximum concentration indicating that ALC-0315 would be eliminated from rat liver in approximately 6-weeks. For ALC-0159 (PEG-lipid), the maximum detected concentration in the liver (15.2 μg/g liver) was reached 30 minutes following IV injection. ALC-0159, was eliminated from the liver faster than ALC-0315 and after 2-weeks the concentration of ALC-0159 was only ~0,04% of the maximum detected concentration. The applicant was asked to discuss the long half-life of ALC-0315 and its effect, discussion on the comparison with patisiran, as well as the impact on the boosts and post treatment contraception duration. The applicant considered that there were no non-clinical safety issues based on the repeat dose toxicity studies at doses (on a mg/kg basis) much greater than administered to humans; this was acceptable to the CHMP.”
- 同[20],見第46頁底”The mouse study”開始至第47頁”The signals from the liver region peaked 6h post injection and decreased to background levels 48h after injection.”一句。
- BALB/c小鼠體重可參考The Jackson Laboratory及Taconic Biosciences網頁,同樣以人類體重為40公斤的保守數字計算,體重相差1,600倍;實驗注射劑量為2微克,接種疫苗劑量為480微克,相差15倍(人類接種劑量較高)。以每公斤劑量計算,實驗注射比接種疫苗高最少6.7倍。
- 同[20],見第47頁中”No evidence of vaccine-related macroscopic or microscopic findings were found in the ovaries in the repeat-dose toxicity studies (Study 38166 and Study 20GR142) and no effects on fertility were identified in the DART study.”一句。
- 同[20],見第48頁開始的”2.3.3. Toxicology”部分。兩個重複劑量毒性試驗分別向大鼠注射100及30微克,發育與生殖毒性試驗則注射BNT162b1、BNT162b2及BNT162b3,共注射4次,每次30微克。人類接種劑量為30微克,考慮到體重相差過百倍,上述三個實驗的每公斤劑量比接種疫苗高出逾百倍。
- Public Assessment Report Authorisation for Temporary Supply: COVID-19 mRNA Vaccine BNT162b2 (BNT162b2 RNA) concentrate for solution for injection (Department of Health and Social Care),見第16至17頁。
- Report on the Deliberation Results: Comirnaty Intramuscular Injection (PMDA),見第18至20頁。
本文出自事實查核實驗室(Factcheck Lab),轉載前請先參考其版權聲明。
撰寫︰鄭家榆(執行編輯)
複核︰區家麟(編審成員)
校正︰鄭佩珊(編審成員)

